『命と向き合うデザイン』
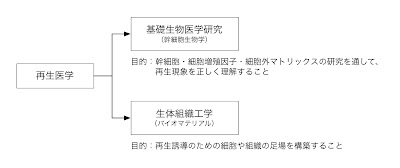
新・再生医学について−10
次に、実用性、有効性、倫理性について言及します。 実用性とは、需要と供給の関係によるところが大きいと言えます。例えばパーキンソン病の治療に用いられるドーパミン作動性ニューロンを選るためには中絶胎児脳にして10対以上が必要であることが分かっています。これはドナーの不足による移植手術が滞っている問題と同様のことが起こることを意味しており、たとえ治療方法として確立したとしても実用性が極めて乏しいことを意味しています。また精製が困難な細胞などに関しては同様の問題が発生すると考えられます。 有効性とは再生医療による治療の効果を確認することの困難性です。例えば脊髄損傷に対する神経幹細胞移植の臨床応用に向けた動物実験を行う場合、従来の動物実験で用いられるようなネズミは使用できません。齧歯類と霊長類では脊髄の構造と機能が異なるためです。この場合、同じ霊長類であるサルを用いるなど実験方法から新規に考える必要があります。 倫理性とは再生医療が一般化したときにすでに語られていたことですが、胚の使用に関すること、胎児由来の体性幹細胞の使用に関することなど、いまだ決着は付いていません。 これら5つの分類は、もう一段階大きなくくりとして、生物学的な問題と法的な問題に分けることができます。安全性・効率性・実用性は、細胞や組織、生体そのものの問題として考えられ、発想や実験などによって解決していく内容です。一方、有効性や倫理性といったものは、生物学的な知見ももちろん必要ではありますが、それ以上に法的な縛り強いと言えます。2006年9月から、再生医療のための臨床研究を対象に「ヒト幹細胞を用いる臨床研究に関する指針」というガイドラインが施行されています[75]。その中では、非常に厳しいガイドが示されていますが、これは再生医療の成長を抑えることが目的ではなく、むしろ再生医療が社会的な尊敬を獲得するために必要な事項としてまとめています。また、分野によって進捗が異なる医療であることからも研究者ごとの独自判断による臨床研究の発散を避けることも同時に目的としています。 ・中辻憲夫, 中内啓光: 再生医療の最前線2010, 羊土社, 2010 ・立石哲也, 田中順三: 図解 再生医療工学, 工業調査会, 2004 ・阿形清和他: 再生医療生物学, 現代生物化学入門7, 岩波書店, 2009 ・筏義...